Contrôle de l’activité d’une Glucose-6-phosphate-déshydrogénase (G6PDH) utilisée dans un test urinaire détectant le tétrahydrocannabinol (THC) publié le 20/06/2023 - mis à jour le 29/06/2023
Présentation
Le tétrahydrocannabinol (THC) est le produit chimique responsable de la plupart des effets psychologiques du Cannabis. Son commerce et son utilisation ne sont pas légales en France (2023) et de nombreux kits de dépistage sont présents sur le marché pour identifier et/ou quantifier la présence de ce stupéfiant.
Un test urinaire de détection du THC utilise une enzyme conjuguée avec cette drogue pour qualifier sa présence. Ce test est commercialisé par Thermo scientific et sa fiche technique est intitulée "Dosage des cannabinoïdes DRI®".
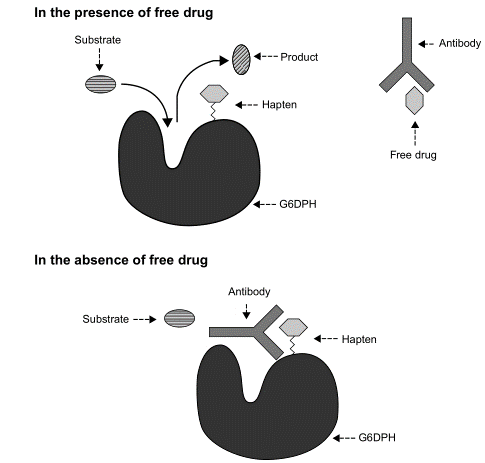
Le principe de ce Kit suit la technique EMIT (Enzyme multiplied immunoassay technique). Cette technique utilise l’activité enzymatique d’une enzyme marquée à la drogue recherchée, la glucose-6-phosphate déshydrogénase (G6PDH), modulée par des anticorps dirigés contre cette drogue. L’activité enzymatique, en présence de son substrat (le glucose-6-phosphate) entraîne la conversion de la nicotine adénine dinucléotide (NAD+) en la forme réduite (NADH) et l’augmentation de l’absorbance à 340 nm est mesurée par spectrophotométrie.
L’addition de l’anticorps anti-drogue entraîne la liaison à l’enzyme conjuguée, ce qui réduit drastiquement l’activité de l’enzyme. En effet, le présence de drogue dans l’échantillon entre en compétition avec l’enzyme conjuguée en se liant à l’anticorps, ce qui permet à l’enzyme non liée de devenir active et de catalysée la réaction d’apparition du NADH et donc de faire augmenter ainsi l’absorbance à 340 nm. Par conséquent, des quantités croissantes de drogue dans l’échantillon produisent une activité enzymatique accrue et donc une augmentation de la vitesse de variation de l’absorbance à 340 nm.
Le principe peut être résumé dans le schéma suivant :
Analyse par méthodes immunologiques by Ayoub Bensakhria 3 novembre, 2017 https://www.analyticaltoxicology.com/analyse-methodes-immunologiques/
Pour le contrôle de la présence de THC dans les urines, le test DRI® test utilise une enzyme, la glucose 6-phosphate déshydrogénase bactérienne, conjugué avec du THC.
Pour ce dosage, l’enzyme marquée au THC et le THC éventuellement présent dans les urines sont en compétition avec un anticorps anti-THC introduit pour le test. L’absence de THC dans les urines, dirige l’ensemble des anticorps anti-THC vers l’enzyme ce qui bloque son activité. La présence de THC dans les urines mobilise les anticorps et libère des sites actifs de l’enzyme.
Remarque : L’utilisation de la G6PDH bactérienne, qui utilise le NAD+ comme coenzyme, évite l’interférence éventuelle de la G6PDH endogène, qui utilise le nicotine adénine dinucléotide phosphate (NADP+).
Partie pratique
L’objectif de cette activité technologique est de vérifier le bon fonctionnement de l’enzyme conjugué et la neutralisation de son activité par des anticorps anti-THC. Pour cela, il faut déterminer l’activité de la G6PDH conjuguée en présence et en absence d’anticorps anti-THC que l’on compare à l’activité d’une solution de G6PDH non conjuguée.
Matériel et réactifs
Poste unique pour l’ensemble des candidats (passage individuel) :
- Solution réactionnelle 1 : NAD+ - Tampon Tris pH8 - MgCl2 : 1 mL x 3
- Solution réactionnelle 2 : Solution de glucose-6-P à 0,6 mmol/L : 1 mL x 3
- Solution de glucose-6-phosphate déshydrogénase native (G6PDH native) : 0,1 mL
- Solution de glucose-6-phosphate déshydrogénase conjugué (G6PDH conjugué) : 0,1 mLx2
- Solution d’anticorps anti-THC : 0,9 mL
- Solution Tampon Tris pH8 : 0,9 mL x 2
- 3 cuves spectrophotométriques
- Pipettes automatiques P5000 – P1000 – P200
- Spectrophotomètre
- Logiciel de cinétique (Lag time 30 secondes ; Duration 150 secondes)
Procédure opératoire
Réaliser dans les cuves les 3 cinétiques suivantes à température ambiante. Réaliser les enregistrements en overlay (les 3 enregistrements sur le même graphique) :
- Cinétique 1 :
Introduire dans une cuve :
- 1 mL de solution réactionnelle 1
- 0,9 mL de tampon Tris pH8.
- 0,1 mL de G6PDH native
Déclencher la réaction en introduisant dans la cuve 1 mL de solution réactionnelle 2.
Mélanger et suivre la variation d’absorbance à 340 nm pendant deux minutes.
- Cinétique 2 :
Introduire dans une cuve :
- 1 mL de solution réactionnelle 1
- 0,9 mL de tampon Tris pH8.
- 0,1 mL de G6PDH conjugué
Déclencher la réaction en introduisant dans la cuve 1 mL de solution réactionnelle 2.
Mélanger et suivre la variation d’absorbance à 340 nm pendant deux minutes.
- Cinétique 3 :
Introduire dans une cuve :
- 1 mL de solution réactionnelle 1
- 0,9 mL de solution d’anticorps anti-THC
- 0,1 mL de G6PDH conjugué
Déclencher la réaction en introduisant dans la cuve 1 mL de solution réactionnelle 2.
Mélanger et suivre la variation d’absorbance à 340 nm pendant deux minutes.
Questionnement
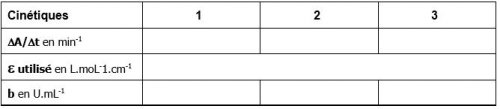
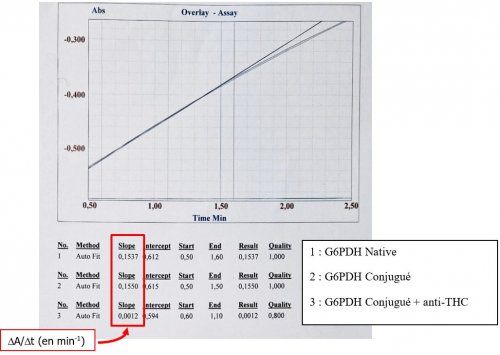
- Rassembler dans le tableau ci-dessous les valeurs de ∆A/∆t (en min-1) obtenues.
- Calculer les concentrations d’activités catalytiques à l’aide de l’équation aux grandeurs suivantes :
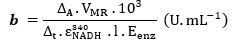
Avec : VMR = volume du milieu réactionnel en mL et Eenz= volume d’enzyme en mL
- Compléter le tableau avec vos valeurs calculées.
- Conclure à propos de l’influence de la présence du THC sur l’enzyme et sur l’efficacité de l’anticorps pour la réalisation du test urinaire.
Exemples de résultats
- Cinétiques obtenues :
- Tableau des résultats et des calculs
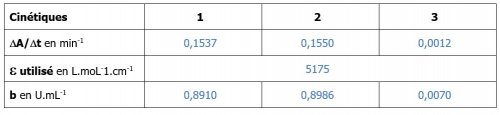
Remarque : Le du NADH est déterminé par la réalisation d’une gamme etalon de NADH dans les conditions physico-chimiques des cinétiques
- Conclusion attendue : La présence du THC fixé sur l’enzyme ne modifie pas son activité (comparaison cinétique 1 et 2). La présence d’anticorps empêche la cinétique de se dérouler (comparaison cinétique 2 et 3). Bilan : le test est validé.

