Le Test de Potentiel Méthanogène (TPM) publié le 31/05/2022
1. Définition et intérêts
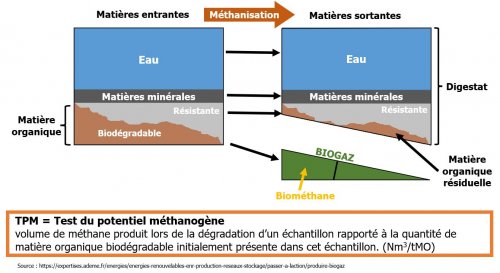
Ce test permet de quantifier et de qualifier le biogaz produit par un échantillon d’intérêt par le processus de méthanisation.
Le potentiel méthanogène est le volume de méthane produit lors de la dégradation de l’échantillon, rapporté à la quantité de matière organique initialement présente dans l’échantillon utilisé pour le test. Ce volume de gaz est exprimé dans les conditions normales de température et de pression
Remarque : Il existe 2 normes pour la température :
- DIN 1343 —> la température est de 273.15K (0°C)
- ISO 2533 —> la température est de 288.15K (15°C)
La pression est de 1013 hectopascals (pression atmosphérique moyenne) pour les 2 normes.
La quantité de biogaz produite est exprimée en Nm3/tMO, soit en normaux mètre cube de biogaz par tonne de matière organique (quantité de gaz contenu dans 1 mètre cube pour un gaz se trouvant dans les conditions normales définies ci-dessus).
La nature des échantillons est diverse, il peut s’agir d’effluents d’élevages, de déchets agroalimentaires ou de collectivités, de cultures énergétiques (ensilage par exemple) ainsi que tout autre résidu ou sous-produit organique.
Le but de ce test est multiple, il permet, dans un premier temps, de déterminer précisément la production réelle d’un type de substrat, puis, par conséquent d’étudier la faisabilité d’un projet d’installation d’un méthaniseur et enfin d’optimiser le rendement d’une installation par le choix judicieux des matières premières.
2. Mise en place technique
Les conditions du test doivent être définies pour obtenir des résultats reproductibles.
Il y a pas de normes pour ce test mais des recommandations notamment celles de l’IWA (International Water Association) ou encore celles de l’OFEN (Office Fédéral de l’Energie Suisse).
Voici une mise en place technique qui suit ces recommandations.
- Le TPM est réalisé sur 4 semaines. Cependant cette durée peut varier selon la nature du substrat. Par exemple, une graisse ou une matière accessible comme une poudre à faible granulométrie, va être consommée rapidement, et au contraire d’un substrat ligneux, comme de la paille qui est riche en fibre, sera dégradé plus lentement. Le TPM sera adapté dans ces cas-là.
- L’échantillon est caractérisé notamment par la détermination de sa proportion de matière sèche (MS) et celle de sa matière sèche volatile (MSV) nécessaire pour le calcul du TPM.
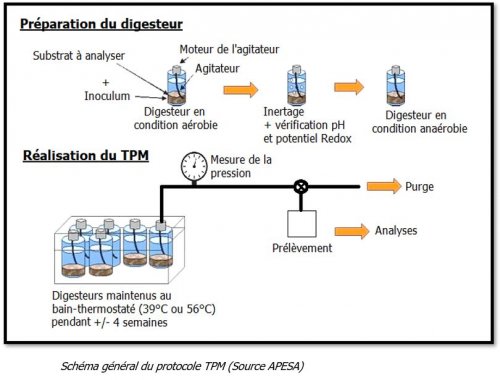
- Le réacteur d’essai est un récipient en verre de 500 mL recouvert d’une protection pour éviter les projections de bris de verre éventuels.
- L’inoculum est choisi pour être le plus adapté à l’échantillon à tester. Il doit respecter des critères de validité pour s’assurer de son efficacité lors du test :
- Le pH doit être compris entre 7,0 et 8,5
- Le potentiel redox doit être lui, inférieur à -300 mV
- L’inoculum ne doit pas être alimenté dans les 3 jours avant le début du test.
- Les essais sont réalisés en duplicat ou triplicat pour chaque échantillon afin de pouvoir calculer des moyennes et des écart-types.
- Les conditions du test sont choisies pour être optimales. Notamment la température que l’on choisit la plus adaptée à l’inoculum. Ainsi, la température du test sera maintenue généralement à 39°C dans une étuve thermostatée et agitée régulièrement pour les inocula mésophiles et elle sera portée à 56°C pour les inocula thermophiles.
Remarque : Classiquement dans les unités de méthanisation, la température est maintenue dans un intervalle compris entre 35 et 37°C. Une partie de la production du biogaz (et sa transformation en chaleur) est utilisée pour obtenir ces conditions de température. Il s’agit du procédé mésophile.
La digestion peut aussi avoir lieu à une température de 55°C c’est-à-dire en conditions thermophiles. Cette température plus élevée permet une vitesse de croissance supérieure des populations microbiennes et une réduction des temps de séjour en digesteur qui passent à 10-15 jours (contre 3 semaines en conditions mésophiles).
- Un inertage (flushage) à l’azote est réalisé. L’inertage consiste à remplacer l’air (comburant possible) par un gaz inerte qui permet d’assurer une sécurité vis-à-vis des explosions éventuelles.
- La pression est relevée quotidiennement puis le gaz dans les bouteilles est ramené à pression atmosphérique.
- L’analyse du taux de CH4 et CO2 est effectuée une fois par semaine.
- La mesure de la production de biogaz est réalisée par suivi de l’augmentation de pression dans le réacteur à l’aide d’un manomètre.
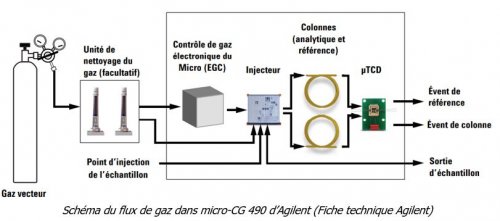
- L’analyse de la composition du biogaz en CH4 est faite par micro-chromatographie en phase gazeuse (µGC).

Ce micro-chromatographe possède 2 colonnes dont les caractéristiques techniques sont les suivantes :
- Colonne 1 : Molsieve 5Å de 10 m. Il s’agit d’un tamis moléculaire de 5Å à base de silice greffée avec des chaînes carbonées normales de type n-C4H10. Cette colonne est particulièrement adaptée à la séparation de gaz permanents (séparation (N2/O2), méthane, CO, NO, gaz naturel et analyse de biogaz etc. 10 m sont requis généralement pour une séparation de ce type de gaz.
- Colonne 2 : PoraPlot U de 10 m. Elle est composée de Polymère éthylène glycol-diméthylacrylate. Il s’agit d’un polymère poreux plutôt polaire. Ce type de colonne permet l’analyse d’hydrocarbures C1 – C6, d’halocarbures/fréons, d’anesthésiques, H2S, CO2, SO2, et de solvants volatils mais aussi la séparation de l’éthane, de l’éthylène et de l’acétylène.
Les deux colonnes sont chauffées à 80°C. La température est gardée constante tout au long de la mesure (Procédé isotherme)
Deux gaz vecteurs, l’hélium (He) pour la colonne 1 et l’Argon (Ar) pour la colonne 2 sont utilisés.
L’injection se fait par pompage à la sortie du réacteur. L’injecteur a été conçu avec une boucle d’échantillonnage de 10 µL remplie d’échantillon gazeux.
Chaque voie GC est équipée d’un catharomètre (TCD). Ce détecteur réagit à la différence de conductivité thermique entre une cellule de référence (gaz vecteur uniquement) et une cellule de mesure (gaz vecteur contenant des composants d’échantillon). La conception d’un TCD est telle qu’un changement de conductivité thermique du flux de gaz vecteur, en raison de la présence de composants, est comparé à la conductivité thermique d’un flux de gaz de référence constant.
Autres paramètres remarquables : Les analyses sont faites à pression constante (10psi). Un contrôleur électronique de pression est présent pour réguler cette pression et la maintenir constante.
3. Détermination du TPM
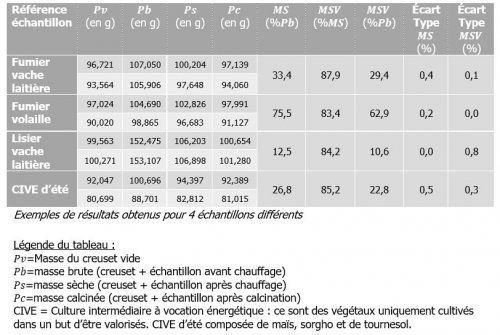
Le laboratoire doit réalisé, le plus précocement possible, les calculs de la matière sèche (MS) et de la matière sèche volatile (MSV).
- Pour la mesure de MS, un creuset contenant l’échantillon est pesé avant et après chauffage à 105°C pendant 24 h. La masse perdue pendant le chauffage correspond à la quantité d’eau évaporée et permet d’obtenir la masse sèche de l’échantillon.
- Pour la mesure de la MSV, le même creuset est chauffé à 550°C pendant 4 h. La matière sèche volatile correspond à la quantité de matières disparue pendant cette calcination. On obtient les cendres composées de matière minérale uniquement.
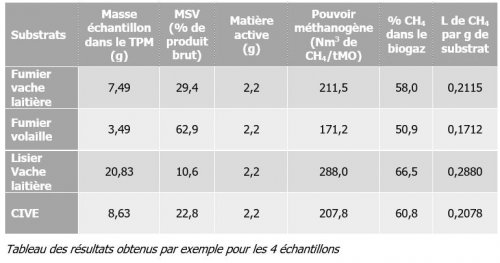
Dans l’exemple du tableau suivant, plusieurs substrats fournis par un client sont testés.
Les formules de calculs de MS et de MSV sont les suivants :
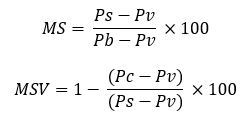
Pv=Masse du creuset vide
Pb=masse brute (creuset + échantillon avant chauffage)
Ps=masse sèche (creuset + échantillon après chauffage)
Pc=masse calcinée (creuset + échantillon après calcination)
Remarque : Dans ce calcul, la lettre « p » représente bien des masses et non des poids. La lettre « p » est utilisée ici car c’est ce qui est fait généralement dans les laboratoire.
Démarrage du test
Le mélange est réalisé et il comprend :
- L’introduction d’un volume identique d’inoculum pour l’ensemble des échantillons et des témoins (275 mL)
- Le rajout d’eau distillée pour compléter le volume du mélange à 300 mL
- L’introduction X g de MSV d’échantillon pour avoir un apport équivalent à 2,2 g de matière organique active. X =2.2/(% MSV) ×100
A chaque démarrage, le pH est relevé ainsi que le potentiel redox de chaque bioréacteur pour s’assurer du bon déroulement du test.
Suivi du TPM
Deux techniques de suivi du test de potentiel méthanogène sont réalisées :
- Une mesure volumétrique qui consiste à évaluer la quantité de gaz produit d’après le volume émis. Ce volume est mesuré sur une colonne sans pression rajoutée dans laquelle se trouve un liquide. Le gaz produit déplace ce liquide dans cette colonne graduée ce qui permet d’en mesurer son volume.
- Une mesure manométrique qui utilise un manomètre indiquant la pression exercée par le gaz produit.
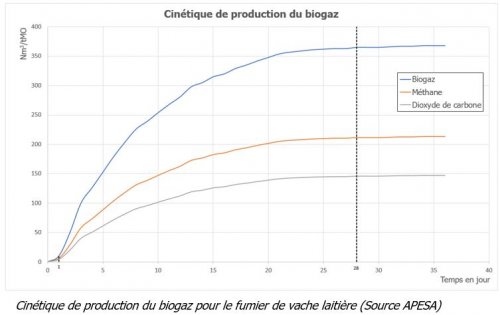
La mesure doit être quotidienne. Les calculs de la quantité de biogaz produit se fait par comparaison à des témoins sans substrat. On soustrait donc la valeur obtenue par l’échantillon à celle des témoins pour ne conserver que la production due à l’échantillon. On obtient donc des cinétiques de production (figure ci-dessous).
Dans cet exemple, la production de biogaz ne commence qu’après 1 jour suivant l’inoculation. Les microorganismes s’adaptent au milieu de culture. Puis la vitesse de production du biogaz est significative pendant 2 semaines environ (cela peut durer jusqu’à 5 semaines selon le type de matière et sa biodégradabilité.). Enfin, par épuisement des ressources notamment, la production du biogaz ralentie puis se stoppe.
La fin du test sera effective quand la production de biogaz sera inférieure à 0,5 % pendant 3 jours consécutifs.
Remarque : la comparaison peut aussi se faire par rapport à une ration dite « idéale » constituée de 5 g de cellulose. Cette ration, constituée du substrat préférentiellement utilisé par les microorganismes impliqués dans le processus de digestion anaérobie, permet d’accéder au potentiel méthanogène maximal (contrôle positif) et de servir de référence pour l’évaluation du potentiel méthanogène des rations à tester
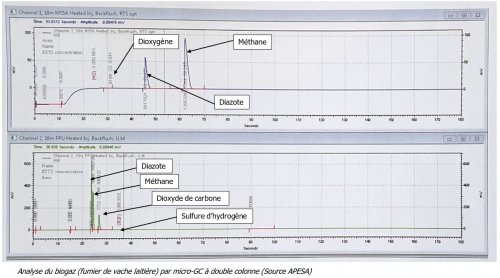
Contrôle du TPM par micro-GC
En parallèle à la mesure volumétrique, est réalisée l’étude chromatographique. On injecte dans les deux colonnes la production gazeuse des différents échantillons. Les différents produits vont sortir en fonction de leur affinité avec les différents types de colonnes. Le détecteur permet de repérer les différents produits. Les temps de rétention et les aires de pics permettent l’identification et le dosage des différents gaz analysés.
Sur la figure ci-dessous :
- Le chromatogramme du haut (Channel 1) permet la détection du méthane CH4, de l’azote N2 et du dioxygène O2.
- Le chromatogramme du bas (Channel 2) permet la détection du dioxyde de carbone CO2 et du sulfure d’hydrogène H2S.
4. Résultats du TPM
Le test de potentiel méthane permet de déterminer, en conditions optimales (pH, T°C, ratio substrat/inoculum...), la production maximale de biogaz et de méthane qui peut être attendue à l’issue de la méthanisation d’un substrat.
Dans cet exemple, tous les échantillons ont produit du biogaz dont méthane. Les taux de méthane varient de 50,9 % à 66,5 % pour le même inoculum de départ (inoculum mésophile).
5. Commentaires et conclusion
La quantité totale de méthane produit va varier en fonction de la teneur en matière organique de l’échantillon testé mais aussi en fonction de sa composition biochimique. Des substrats riches en fibres (fumier), par exemple, auront plus de mal à se dégrader que des substrats riches en composés solubles.
Il est à noter que des substrats de même nature peuvent présenter des valeurs de TPM très différents. C’est par exemple le cas des fumiers ou des lisiers dont les caractéristiques varient en fonction de leur origine ainsi que de la période d’analyse.
Les banques de données de résultats de TPM ne suffisent donc pas pour évaluer une capacité de production à venir dans un contexte donné. De ce fait, la réalisation d’un TPM pour chaque situation est pertinente pour connaître le réel potentiel de production en méthane d’un substrat à un moment donnée et dans des conditions données.
La production de biogaz attendue sur une unité de méthanisation, en termes de qualité et de quantité, va donc être évaluée à partir de ces tests qui doivent être réalisés pour chaque matière constitutive de la ration du digesteur.
Pour résumer, le TPM est une évaluation qui permet :
- de finaliser l’étude de faisabilité d’un projet en consolidant l’analyse des risques techniques et financiers.
- de préparer les rations les plus efficientes durant l’exploitation de l’unité de méthanisation et d’observer l’impact d’un nouvel intrant. Le TPM obtenu sera un indicateur utile pour comparer divers substrats ainsi que l’impact potentiel d’une étape de pré-traitement. Il est toutefois important de réaliser les tests TPM sur une même série avec le même inoculum pour pouvoir comparer les cinétiques entre elles. La cinétique de dégradation des matières est un paramètre important pour lisser la production de biogaz, en particulier pour les intrants ponctuels.
- d’évaluer la production théorique maximale de biogaz d’une ration afin de quantifier les performances réelles de l’exploitation. En effet, le TPM donne généralement une valeur surestimée de la production de méthane par une ration par rapport à la production réelle en exploitation. Les conditions sont généralement plus optimales et régulières lors du test par rapport à celle de l’unité dans son environnement. Toutefois, le résultat du TPM obtenu donnera une image des attendus et le biais obtenu peut même être évalué.
- de planifier et d’optimiser les temps d’exploitation. En effet, les taux de production du biogaz varient dans le temps et le test TPM peut en dévoiler les meilleures périodes. Dans l’exemple de la figure 12, il a noté que 2/3 du méthane obtenu avec du fumier de vache laitière (soit 181,5 Nm3/tMO voir résultats du tableau 12) est produit dans les 10 premiers jours après l’inoculation. Ce type de résultats peut donc aider à la planification d’un bioréacteur. L’exploitant peut savoir quand recharger son digesteur pour conserver une production optimale.
Jules GUITTARD
Lycée VALIN