La biométhanisation publié le 23/05/2022
2.2 Biochimie et microbiologie de la méthanisation
a. Composition du biogaz
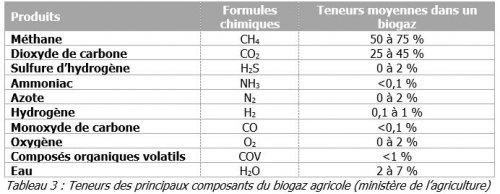
Le biogaz est produit par la fermentation de matières organiques animales ou végétales et ceci en anaérobiose. Sa composition varie en fonction de la nature des substrats introduits (les intrants) et des conditions opératoires. Le tableau qui suit donne un exemple de la composition indicative d’un biogaz de type agricole.
Remarque 1 : Le méthane (CH4) est un gaz à effet de serre (GES) dont le potentiel de réchauffement global (PRG) sur un siècle est 21 fois plus important que celui du dioxyde de carbone (CO2). Il est donc particulièrement important de limiter au maximum son dégagement dans l’atmosphère.
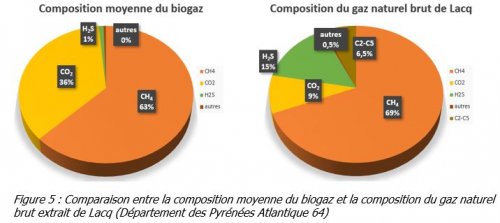
Remarque 2 : Le biogaz a une composition proche de celle du gaz naturel (figure 5)
b. Réactions biochimiques
Lors des différentes réactions de méthanisation, le méthane et le dioxyde de carbone sont produits par une suite de plusieurs réactions biochimiques et ceci à partir de matières organiques. Ces réactions métaboliques sont exécutées pratiquement toutes en anaérobiose par des microorganismes vivants qui possèdent les enzymes nécessaires. Ces réactions, sûrement déjà présentes sur Terre avant même la vie aérobie, ont été, et sont toujours, fondamentales pour les cycles biogéochimiques (carbone, soufre et azote notamment).
Ces microorganismes méthanogènes que l’on retrouve naturellement dans certains écosystèmes naturels comme les marais, les lacs, les rizières, ou encore le sol ou même dans les microbiotes intestinaux de certains animaux, travaillent ensemble pour générer ce biogaz à partir de substrats organiques (glucides, lipides, protéines et acides nucléiques).
Lors de la méthanisation, les réactions biochimiques observées transforment des molécules organiques complexes en molécules minérales plus simples, il s’agit donc de façon générale, d’une minéralisation.
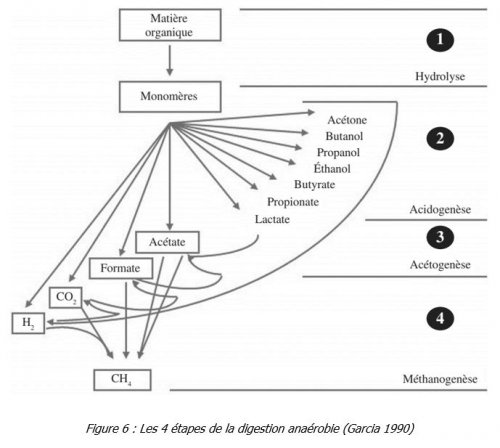
Les différentes réactions impliquées se déroulent en 4 étapes que sont l’hydrolyse, l’acidogenèse, l’acétogenèse et la méthanogenèse.
- Hydrolyse
Au cours de cette étape, les macromolécules organiques tels que les glucides, les lipides, les protéines et les acides nucléiques, sont hydrolysées en monomères hydrosolubles tels que des oses, des acides gras, des acides aminés et des nucléotides. Cette réaction d’hydrolyse est catalysée par des enzymes produites par des microorganismes. Cette étape d’hydrolyse est généralement la moins rapide des 4 types de réactions et donc, c’est l’étape limitante pour l’ensemble du processus de méthanisation.
- Acidogenèse
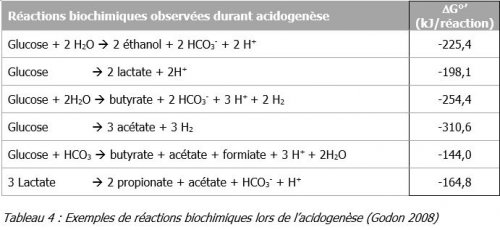
Au cours de l’étape d’acidogenèse, les monomères obtenus lors de la réaction précédente, sont transformés principalement en acides volatils (tels que l’acide acétique, l’acide propionique, l’acide butyrique, l’acide valérique, etc.) mais aussi en alcools et en d’autres acides organiques (comme l’acide lactique ou succinique). Il apparait, dans cette série de réactions, de l’hydrogène et du dioxyde de carbone.
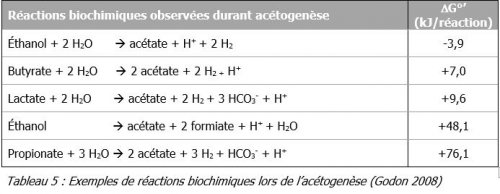
- Acétogenèse
Pendant les réactions de l’acétogenèse, les intermédiaires métaboliques de la phase précédente sont transformés en acide acétique, en dihydrogène et en dioxyde de carbone. Ces molécules sont indispensables à ce moment-là car ce sont les précurseurs de la formation du méthane.
Pour cette synthèse d’acide acétique, deux voies sont décrites :- La voie homoacétogène qui conduit à la production d’acide acétique à partir de molécules organiques principalement.
- La voie hétéroacétogène qui aboutit à la production d’acide acétique ainsi que de dihydrogène et de dioxyde de carbone mais aussi à d’autres acides volatils tels que l’acide propionique, l’acide pyruvique ou encore l’acide butyrique.
Thermodynamiquement, ces réactions sont endergoniques (ΔG0’ > 0) dans les conditions standards (concentration des réactifs = 1 mol/L ; pression des gaz = 1 atm). Cependant, si la pression partielle de dihydrogène diminue (en deçà de 10-4 à 10-6 atm), la production d’acétate redevient possible mais ensuite, l’accumulation de dihydrogène conduit à l’arrêt de l’acétogenèse.
L’acétogenèse est une des étapes clés de la digestion anaérobie. En effet, tout dysfonctionnement à ce niveau risque de se traduire par une accumulation de dihydrogène et d’acides volatils entraînant une baisse importante du pH, pouvant inhiber les enzymes de l’étape de méthanogenèse suivante.
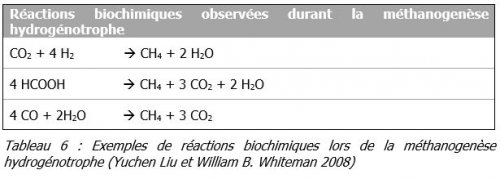
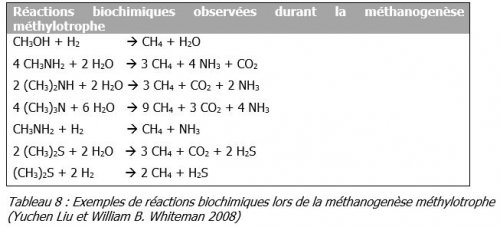
- Méthanogenèse
Dans cette dernière étape, les produits précédents de l’acétogenèse (acétate, formiate, dioxyde de carbone et dihydrogène) sont utilisés pour produire du méthane. Trois types de réactions peuvent être distingués :- La méthanogenèse hydrogénotrophe qui consiste à une réduction du dioxyde de carbone en présence de dihydrogène. L’acide formique peut aussi être utilisé comme source d’électrons pour ce type de réactions.
- La méthanogenèse acétotrophe qui, à partir de l’acide acétique, produit du méthane et du dioxyde de carbone.
- La méthanogenèse méthylotrophe qui utilise le méthanol ou la méthylamine ou bien encore, ses dérivées comme source de carbone pour la synthèse du méthane.
- Autres réactions observées.
Par ailleurs, parallèlement à la méthanogenèse, des réactions de sulfato-réduction peuvent se produire sous l’action de bactéries sulfato-réductrices en présence de sulfate et dans un milieu réducteur. Ces réactions permettent la transformation d’alcools ou d’acides gras en H2S et CO2 en utilisant le sulfate comme source d’énergie. En particulier, les bactéries sulfato-réductrices ont la capacité d’utiliser l’hydrogène et l’acide acétique, entrant ainsi en concurrence avec les réactions de méthanogenèse.Ces réactions métaboliques aboutissent à la production :
- du digestat qui est un produit humide riche en matière organique. Parmi ces molécules non dégradées, on trouve de la lignine par exemple.
- du biogaz qui est un mélange gazeux saturé en eau, composé d’environ 50 % à 70 % de méthane (CH4), de 20 % à 50 % de gaz carbonique (CO2) et de quelques traces d’autres produits comme de l’ammoniac (NH3), de l’azote (N2) ou encore du sulfate d’hydrogène (H2S) (Voir tableau 3).