Mallette FPLC (Fast Protein Liquid Chromatography) publié le 13/09/2016
Extraction et purification du lysozyme du blanc d'oeuf
1. Composition de la mallette FPLC
- Un système chromatographique automatisé ÄKTA Start®
- Un PC Acer – Windows 8.1 muni du logiciel Unicorn®
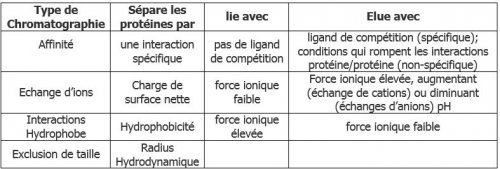
2. Principe de la FPLC (Système ÄTKA Start)
Il s’agit d’une chromatographie sur colonne réalisée avec un système automatisé. Ce système utilise une pompe, réglée à un débit consigne, qui permet au solvant d’entrainer les constituants d’un mélange (protéines) sur une colonne remplie de matrice.
Ce système automatisé accepte quatre types de colonne, à savoir :
- Des colonnes d’affinité
- Des colonnes échangeuses d’ions (IEX)
- Des colonnes d’interaction hydrophobe (HIC)
- Des colonnes d’exclusion de taille (SEC).
La plupart des protocoles de purification de protéines nécessitent l’utilisation de plusieurs de ces types de procédures chromatographiques pour obtenir la pureté nécessaire pour les applications en aval. Le choix de la (les) méthode(s) chromatographique(s) la (les) plus appropriée(s) et l’ordre de ces méthodes est essentielle dans l’optimisation d’une méthode de purification des protéines.
En analysant la séquence d’une protéine, des caractéristiques uniques peuvent être identifiées qui peuvent aider à sa purification. La taille et la charge d’une protéine (à un pH spécifique) peut être déterminée, ainsi que l’identification de grandes régions de résidus hydrophobes.
Référence :Purification de Protéine par chromatographie sur colonne
3. Extraction et purification du lysozyme du blanc d’œuf
3.1 Généralités
Le lysozyme EC. 3.2.1.17, catalyse l’hydrolyse des liaisons β(1-4) osidiques entre l’acide N-acétylmuramique et la N-acétylglucosamine du peptidoglycane des parois bactériennes.
Cette hydrolyse de la couche rigide de la paroi provoque la lyse des cellules en milieu hypotonique. Le lysozyme, découvert en 1929 par Fleming dans les larmes, est également présent dans le blanc d’œuf où il représente 7 à 8 % des protéines. Son pHi est de 11 (nettement supérieur à celui des autres protéines du blanc d’œuf) et son poids moléculaire est de 14600 Da.
3.2 Description de la procédure de purification du lyzozyme
Deux étapes de purification sont proposées pour obtenir un lysozyme purifié du blanc d’œuf
- Une chromatographie par échange d’ions (IEX) qui sépare les protéines en fonction de leur charge de surface nette. La colonne utilisée est une colonne échangeuse de cations faibles à carboxyméthyl (CM)
- Une chromatographie d’exclusion (SEC) qui sépare les molécules présentes, en fonction de leur rayon (taille) hydrodynamique. La colonne utilisée contient une résine Séphadex G-25 (fractionne jusqu’à 5000 Da)
3.3 Préparation de l’échantillon
- Peser le blanc d’un œuf et le transvaser quantitativement dans une fiole de 200 mL
- Compléter la fiole avec le tampon Tris-HCl (pH 8,5 - 0,1 M NaCl)
- Garder une fraction pour étude complémentaire (Tube SBO)
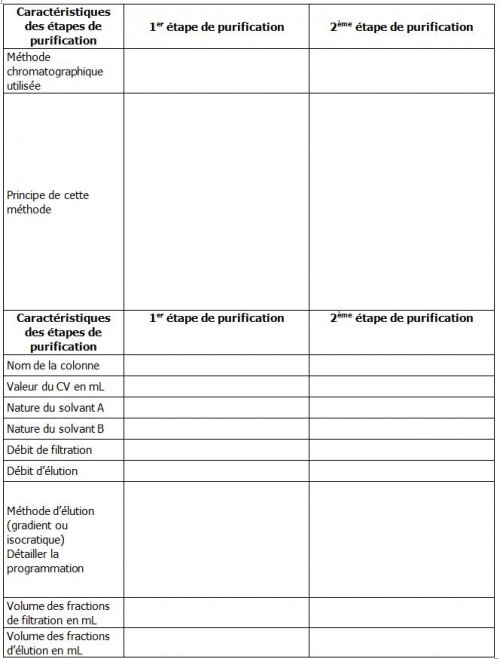
3.4 1ère étape de purification : Chromatographie IEX
- Préparer la colonne (voir 6.3 Démarrage)
- Monter la colonne HiTrap CM FF 5mL (voir 6. Consignes d’utilisation)
- Plonger les crépines dans les solvants respectifs
(Solvant A = Tris-HCl pH8,5 à 0,1M NaCl ; Solvant B = Tampon pH8,5 à 1M de NaCl) - Allumer le chromatographe
- Ouvrir le logiciel Unicorn® (System Control ; Evaluation) (voir 7. Utilisation unicorn)
- Sur System Control, connecter le chromatographe à Unicorn® en cliquant sur « Connect »
- Lancer la méthode en cliquant sur « Method Run », choisir « Lysozyme2 »
- Suivre les instructions à l’écran (le volume de blanc d’œuf à injecter est de 1 mL)
- Sur Évaluation, intégrer et éditer vos pics
- Garder la fraction la plus intéressante pour étude complémentaire (Tube P1)
- Re-conditionner la colonne (voir 6.4 Rinçage)
3.5 2ème étape de purification : Chromatographie SEC
- Préparer la colonne (voir 6.3 Démarrage)
- Changer de colonne, monter la colonne HiTrap Desalting 5mL (voir 6. Consignes d’utilisation)
- Plonger la crépine A dans de l’eau distillée
(Remarque : la crépine B peut aussi plonger dans le même récipient que la A) - Allumer le chromatographe
- Ouvrir le logiciel Unicorn® (System Control ; Évaluation) (voir 7. Utilisation unicorn)
- Sur System Control, connecter le chromatographe à Unicorn® en cliquant sur « Connect »
- Lancer la méthode en cliquant sur « Method Run », choisir « dessalage »
- Suivre les instructions à l’écran (le volume de fraction à injecter est de 1 mL)
- Sur Évaluation, intégrer et éditer vos pics
- Garder la fraction la plus intéressante pour étude complémentaire (Tube P2)
- Re-conditionner la colonne (voir 6.4 Rinçage)
4. Mesure de l’activité enzymatique
4.1 Mode opératoire
- Opérer en cuve de spectrophotomètre, si possible à 25°C
- Introduire :
- 2,9 mL de substrat (suspension de parois de Micrococcus à 200mg/L)
- 0,1 mL de fraction enzymatique
- Trois fractions sont testées préalablement diluées comme suit :
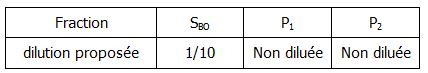
- la variation d’absorbance à 450 nm pendant 2 à 3 min et déterminer le A/min
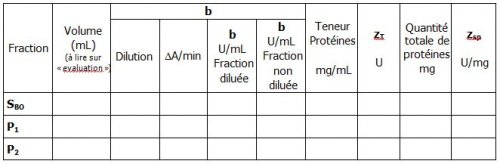
L’activité catalytique du lysozyme est mesurée par diminution de l’absorbance à 450 nm d’une suspension bactérienne de Micrococcus lysodeikticus à pH 6,24. Une unité d’activité enzymatique est définie comme étant la quantité d’enzyme qui provoque une variation d’absorbance de 0,001 par minute dans les conditions de l’expérience et à 25°C.
4.2 Dosage colorimétrique des protéines (par FOLIN-LOWRY)
- Réalisation de la gamme d’étalonnage :
- A l’aide d’une solution de protéine étalon (SAB) à 0,5 g.L-1, réaliser une gamme 6 tubes contenant au maximum 1 mL de solution de protéine étalon.
- Ajouter dans chaque tube 5 mL de réactif de LOWRY et agiter et attendre 10 minutes
- Ajouter dans chaque tube 0,5 mL de réactif de FOLIN, puis agiter immédiatement et laisser la coloration se développer 30 minutes à l’obscurité, à température ambiante.
- Mesurer l’absorbance à 650 nm contre un témoin réactif.
- Dosage des protéines :
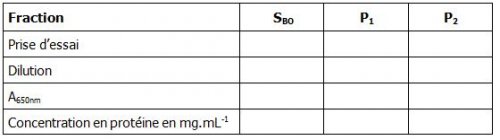
Réaliser, selon le même protocole que la gamme étalon, le dosage des fractions SBO, P1 et P2.
Les éventuelles dilutions seront réalisées en eau physiologique. Une estimation des protéines présentes peut être réalisée par l’intégration des pics obtenus en chromatographie
5. Calculs et résultats
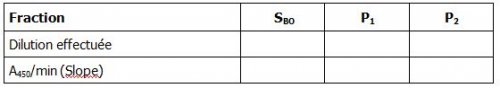
Remplir les différents tableaux suivants :
5.1 Mesure de l’activité enzymatique
5.2 Gamme de dosage des protéines
5.3 Dosage des protéines dans les fractions
5.4 Résultats des activités totales et spécifiques
5.5 Calculs du Rendement de purification et de l’enrichissement

5.6 Principes et conditions opératoires
6. Consignes d’utilisation de ÄTKA
Pour le bon fonctionnement de l’appareil ces consignes sont à suivre impérativement.
6.1 Traitement de la pompe
Prière de desserrer le système péristaltique de la pompe après utilisation.

6.2 Montage et démontage d’une colonne
Les colonnes peuvent facilement être installées et retirées.
Pour le montage, il convient de viser d’abord la partie basse de la colonne puis la partie haute.
Pour le démontage l’opération doit être inversée, d’abord le haut puis le bas

6.3 Démarrage avec une colonne
A chaque démarrage ou à chaque changement de colonne, il faut faire un rinçage manuel avec le solvant A pour une colonne échangeuse d’ions ou avec de l’eau distillée avec une colonne d’exclusion.
La procédure est la suivante :
- Plonger les crépines A et B dans le solvant A ou l’eau distillée
- Déconnecter le tube collecteur de fractions de son emplacement et le brancher sur le récipient poubelle. (voir le 1 sur le schéma ci-dessous)
- Allumer le chromatographe
- Ouvrir le logiciel Unicorn® (System Control) (voir 7. Utilisation unicorn)
- Sur System Control, connecter le chromatographe à Unicorn® en cliquant sur « Connect »
- Mettre la boucle en position « ‘inject »
- Lancer la méthode manuelle en cliquant sur « Manual Run »
- Choisir un débit de 4 mL/min (Pump, flow rate)
- Ouvrir les vannes (en cliquant sur le schéma présenté sur System control) pour que le solvant A ou l’eau passe par l’ensemble du système comme présenté sur ce schéma (chemin en vert).
- Laisser tourner 5 min et cliquer sur stop (voir le 2 sur le schéma ci-dessous)
- Remettre la boucle sur la position « Load » et le tube collecteur de fractions sur son emplacement d’origine.
Remarque : pour ouvrir ou fermer une vanne, il suffit de cliquer sur la vanne sur l’écran directement. (Vanne bleu = ouvert ; vanne blanche = fermé (exemple : voir 3 sur le schéma ci-dessous))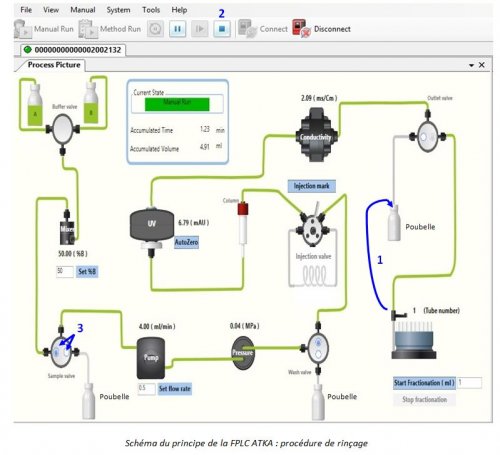
6.4 Rinçage de la colonne en fin de manipulation
A l’arrêt de l’utilisation de l’appareil et pour conserver les colonnes, un rinçage du circuit est à réaliser avec de l’éthanol à 20% (colonne échangeuse d’ions et colonne d’exclusion).
Suivre la même procédure que le démarrage de la colonne.
7. Utilisation d’UNICORN®
Le logiciel Unicorn® comprend 4 applications que l’on peut ouvrir simultanément.
7.1 Utilisation de l’application « Method Editor »
Cette application permet d’éditer une procédure.
Exemple d’édition d’une méthode pour une « Chromatographie échangeuse d’ions » :
- Ouvrir « UNICORN® » en cliquant sur l’icône située sur le bureau

- Choisir les applications à ouvrir "METHOD EDITOR"
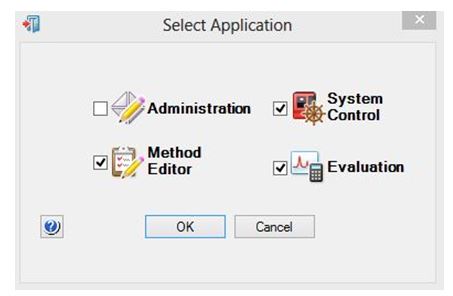
- Puis « FILE » et « NEW METHOD »
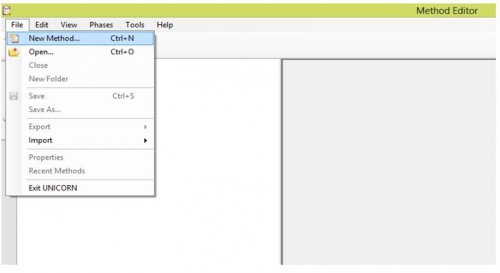
- Choisir pour la méthode à éditer, le type de chromatographie
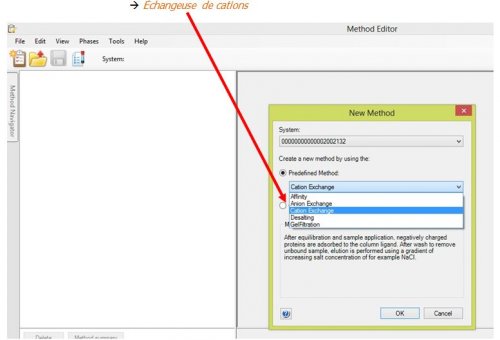
La méthode « échangeuse de cations » présente 6 pages à programmer :
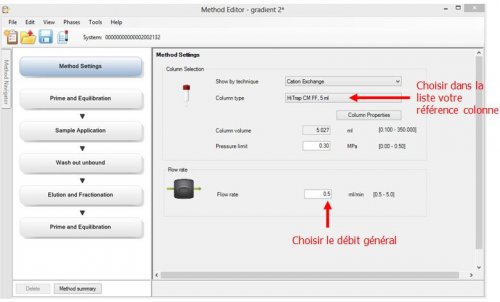
- 1ère page : Method Setting : Choix de colonne et choix de débit général
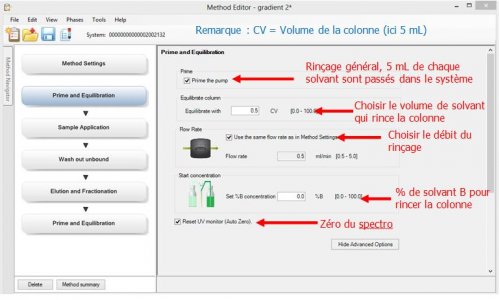
- 2ème page : Prime Equilibration : Programmation de mise en route de la colonne
- 3ème page : Sample Application : Choix du type injection
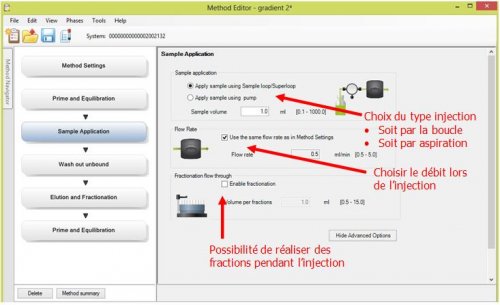
- 4ème page : Wash out unbound : Programmation de la filtration
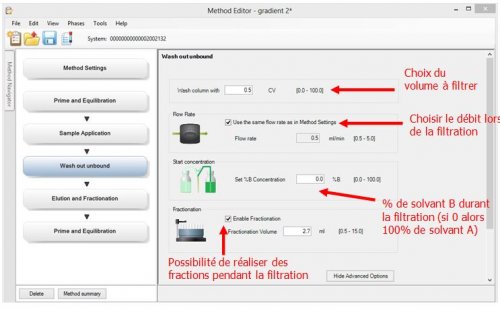
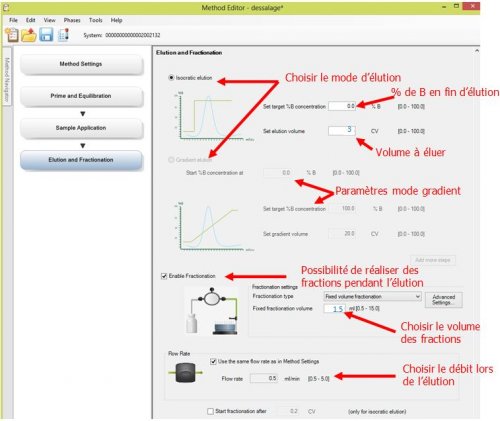
- 5ème page : Elution and Fractionation : Programmation de l’élution
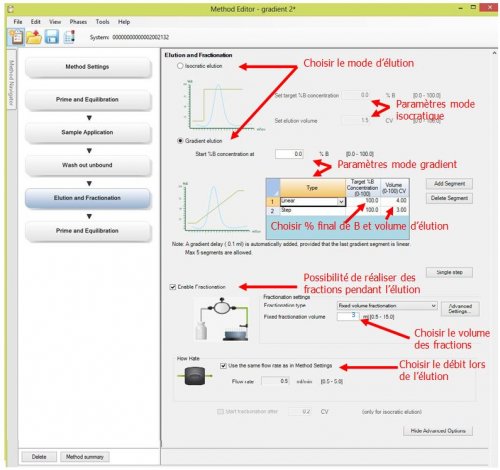
- 6ème page : Prime and Equilibration : rinçage et remise en condition
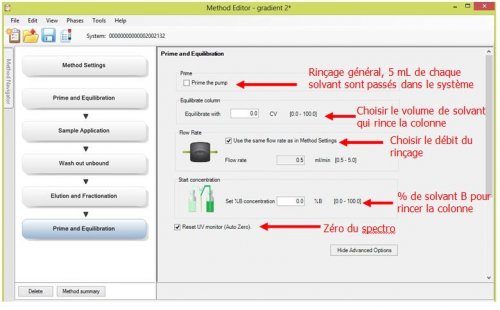
Exemple d’édition d’une méthode pour une « Chromatographie d’exclusion » :
- Ouvrir « UNICORN® » en cliquant sur Icône situé sur le bureau

- Choisir les applications à ouvrir "METHOD EDITOR"

- Puis « FILE » et « NEW METHOD »

- Choisir pour la méthode à éditer, le type de chromatographie Desalting (Dessalage par exclusion)
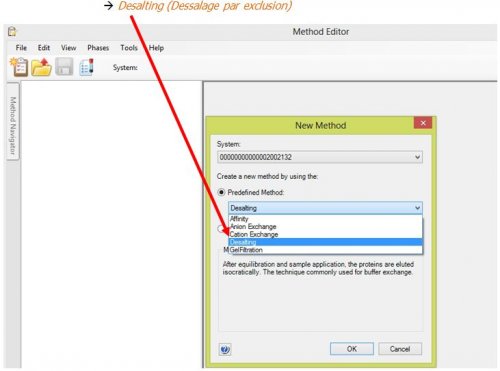
La méthode « échangeuse de cations » présente 4 pages à programmer :
- 1ère page : Method Setting : Choix de colonne et choix de débit général
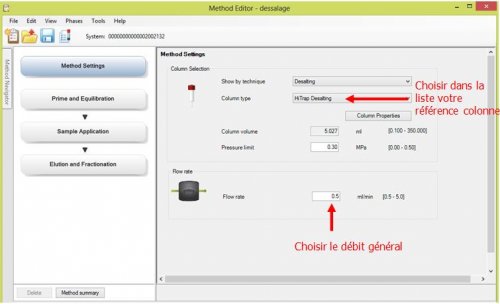
- 2ème page : Method Setting : Choix de colonne et choix de débit général
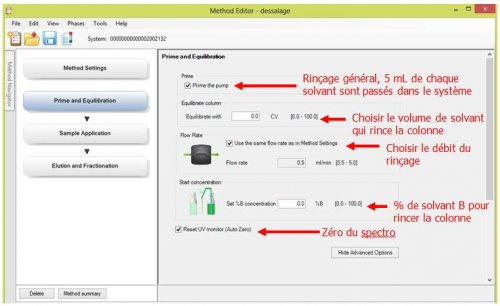
- 3ème page : Method Setting : Choix de colonne et choix de débit général
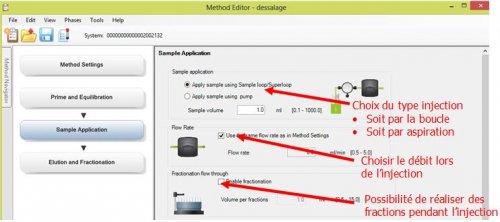
- 4ème page : Method Setting : Choix de colonne et choix de débit général
7.2 Utilisation de l’application « System Control »
Elle permet de lancer une méthode déjà enregistrée.
Exemple de lancement d’une méthode "test" :
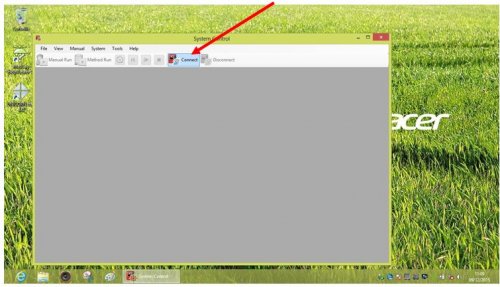
- Lancer SYSTEM CONTROL et cliquer sur « CONNECT »
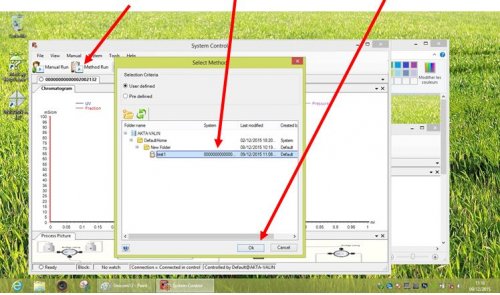
- Cliquer sur METHOD RUN et choisir la méthode dans la liste puis OK
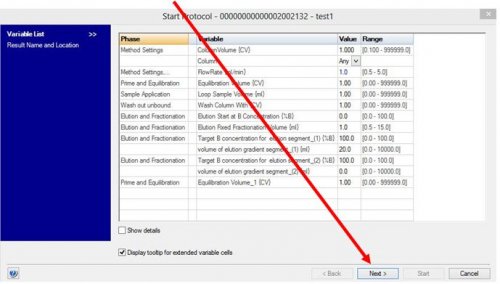
- Valider la méthode par Next
- Donner un nom au fichier « résultats » et lancer la procédure
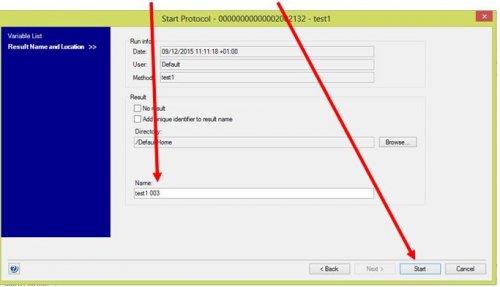
Remarque : suivre à l’écran le déroulé des différentes étapes. Une demande et une confirmation seront proposées au cours de la procédure si vous avez choisi l’injection par la boucle (LOOP).
7.3 Utilisation de l’application « Evaluation »
Elle permet d’analyser les profils obtenus lors des chromatographies.
Exemple d’évaluation d’une "Chromatographie échangeuse d’ions"
- Ouvrir l’application « EVALUATION »
- Ouvrir le fichier résultats
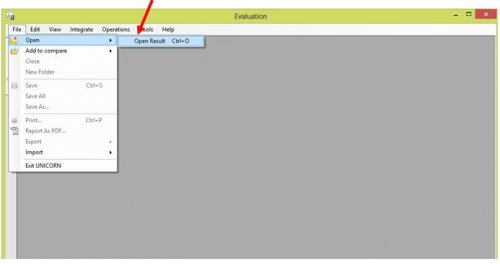
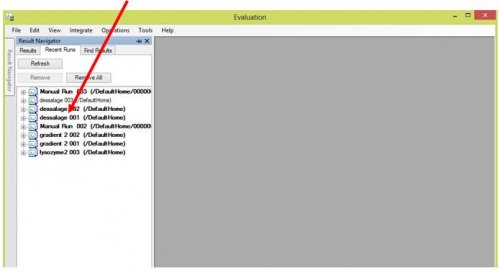
- Choisir le fichier correspondant à l’analyse à faire.
- Intégrer les pics et choisir les paramètres à laisser sur le graphe
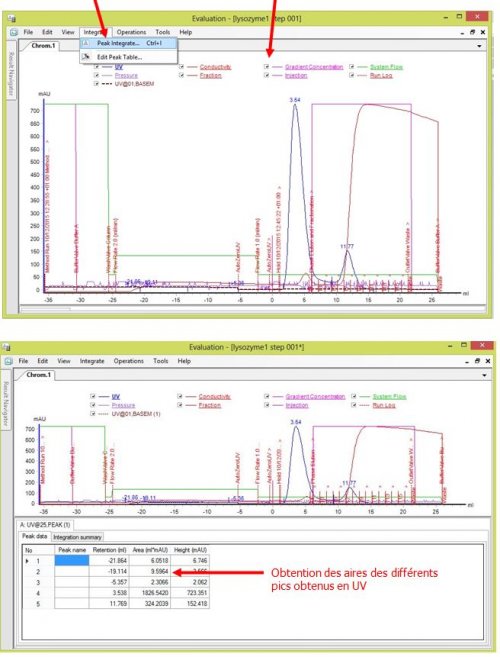
- Éditer les pics obtenus (Nommer et/ou éliminer certains pics)
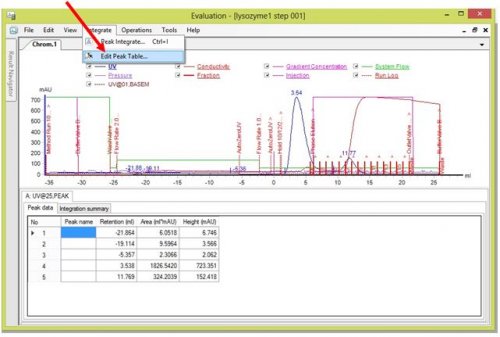
- Pour éliminer les pics non désirés
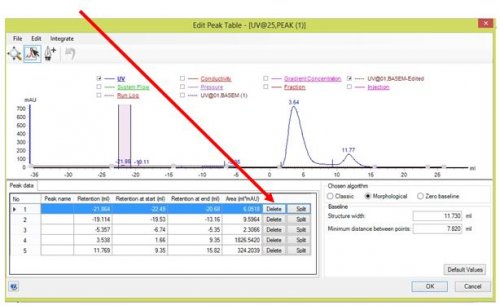
- Pour nommer les pics obtenus
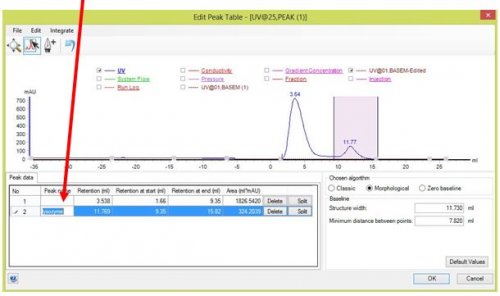
- Trouver l’aire correspondant à chaque fraction
Operations>Fraction Histogram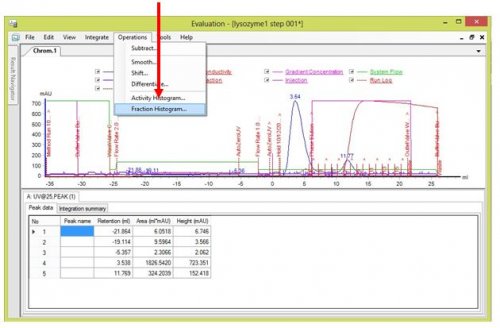
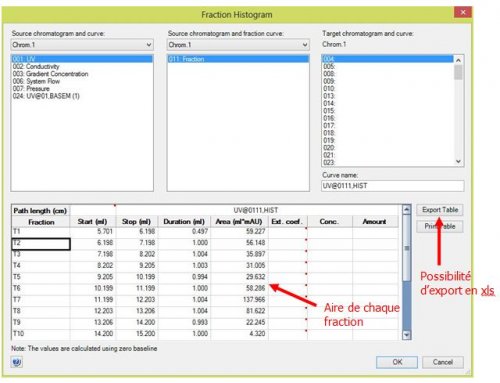
7.4 Application « Administration »
Elle permet d’installer et de paramétrer le logiciel Unicorn®
Exemples de résultats obtenus :
Ce document contient des résultats expérimentaux obtenus par les étudiants de BTS 2ème année du lycée Valin à La Rochelle en avril 2016


